早期承認見込み 新型コロナ治療薬レムデシビルの有効性は?

先日、レムデシビルという薬剤が新型コロナの治療薬として近々承認される見込みであることが加藤厚生労働大臣より発表されました。
新型コロナウイルスの治療薬の候補の1つである「レムデシビル」について、加藤厚生労働大臣は、緊急の場合に審査を大幅に簡略化できる「特例承認」と呼ばれる制度を活用して、早期の承認を目指す考えを示しました。
日本国内では、通常新規医薬品は申請から承認まで1年以上を要します。
しかし、世界的な問題となっている新型コロナウイルス感染症に対する治療薬については迅速性を優先した対応が求められる中で、これを特例承認と呼ばれる制度を用いることで承認までのプロセスを大幅に短縮することができるとのことです。
先ほど、アメリカの薬剤審査機関であるFDAがレムデシビルの緊急使用を承認したと発表されました。
これを受けて日本でも今後承認の手続きが行われる予定です。
ところでこのレムデシビル、どれくらいの治療効果が見込める薬剤なのでしょうか?
これまでの知見をまとめました。
レムデシビルとは?
レムデシビルは元々はエボラ出血熱の治療薬の候補としてこれまで他の臨床試験で使用されていた薬剤です。
現在もコンゴ民主共和国で流行が続いているエボラ出血熱の症例に対して、ランダム化比較試験という形でレムデシビルが投与されていました。
しかし、結果としてはレムデシビルはMAb114、REGN-EB3という2つの薬剤に治療効果が劣ることが分かり、現在はエボラ出血熱への投与は中止されています。
そんな中、このレムデシビルが新型コロナウイルス感染症に有効である可能性が出てきました。
武漢ウイルス研究所がCell Researchという医学誌にレムデシビルの新型コロナウイルスに対する効果に関する報告を発表しています。
培養細胞に新型コロナウイルスを感染させ、48時間後のウイルス増殖の抑制効果を見たところ、レムデシビルで高い効果が観察されたというものです。
この研究ではレムデシビルだけでなく、リバビリン、ナファモスタット、ファビピラビル、クロロキンなど複数の薬剤についてウイルス抑制効果を見ていますが、この中で最も高い抑制効果が観察されたのがレムデシビルです。
これまでにレムデシビルが投与された事例
また、アメリカで最初に新型コロナウイルス感染症と診断された症例にもこのレムデシビルは投与されています。この患者さんはその後回復していますが、それがレムデシビルの効果によるものかは分かりません。
4月11日にNew England Journal of MedicineにレムデシビルがCompassionate Use(人道的使用)として投与された58例の症例についての報告が掲載されました。
ちなみにこの論文の2nd オーサーは日本国内の症例の取りまとめをした筆者の上司なのですが、compassionate useの国内の症例募集を少しだけお手伝いした私の名前は100回くらい探しましたが見つかりませんでした。
それはともかく、この報告では日本、アメリカ、ヨーロッパ、カナダの症例58例のうち36例(68%)で臨床的改善が得られたとのことです。
これも「レムデシビルを投与されていない患者」と比較がされていないので、レムデシビルが新型コロナに有効であるかは判断できませんでした。
レムデシビルのランダム化比較試験の結果
アビガン 科学的根拠に基づいた議論をでもお話しましたが、臨床研究にはエビデンスレベルの高い低いがあります。
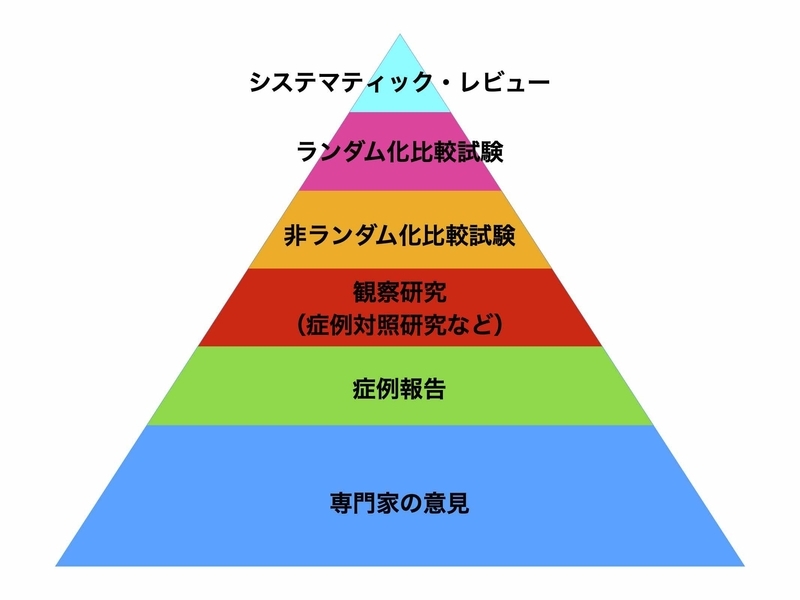
これまでの報告は「症例報告」であり、エビデンスレベルの高いランダム化比較試験(RCT)の結果が待たれるところでした。
そして、この数日で立て続けにレムデシビルのRCTの結果が報告されました。
1. 中国からの237例の報告(DOI:https://doi.org/10.1016/S0140-6736(20)31022-9)
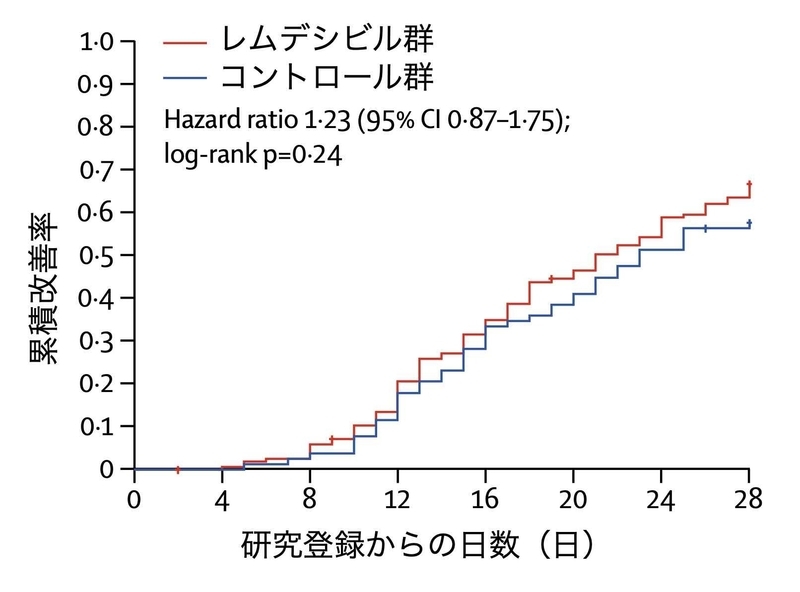
Lancet誌に4月29日に掲載されました。
2020年2月〜3月の間に中国で登録された237人の重症新型コロナ患者が、レムデシビル群2:プラセボ(偽薬)群1にランダムに割り付けられ治療効果の検証が行われました(臨床研究登録番号:NCT04257656)。
結果としては、レムデシビル群とプラセボ群とを比べて、臨床的な改善は差がなかったという結果でした。
ただし、この研究では症例の数が十分集まる前に終了になっており、予定通りの症例数が集まっていれば、特に早期に治療を開始した場合には有効性が確認できた可能性があります。
2. NIHの医師主導治験(ACTT1)の速報

NIH(アメリカ国立衛生研究所)を中心とした多国間医師主導治験です。
4月29日にプレスリリースが出され速報として結果が発表されました。
2月から4月にかけて各国で登録された1063例の重症新型コロナ患者が登録されたこの研究では、米国の47施設、ヨーロッパとアジアの21施設、合計68施設が参加しており、日本からは国立国際医療研究センター(感染症で有名な病院ですね)が参加しています。
まだ最終的な報告ではありませんが、速報としてプラセボ群と比べてレムデシビル群では臨床的改善が31%早かったとのことです。回復までの期間の中央値は、レムデシビル群では11日であったのに対し、プラセボ群では15日でした。
また統計学的に有意な差ではありませんでしたが、死亡率においてもレムデシビル群で8.0%、プラセボ群で11.6%とレムデシビルを投与された患者群で低い傾向にありました。
3. ギリアド社の企業主導治験

こちらはレムデシビルを製造しているギリアド社が主導したSIMPLEと呼ばれる臨床研究です。
これも4月29日にプレスリリースが発表されました。
397人の重症新型コロナ患者が登録され、レムデシビルを5日間投与した群と10日間投与した群とを比較したものであり、プラセボ群がありません。
結果としては、5日間と10日間とでは死亡率や臨床的改善に差はなく、副作用でも差がなかったとのことです。
これにより、10日ではなく5日でも同等の効果が得られる可能性があり、生産数が限られている状況ではより多くの新型コロナ患者にレムデシビルが投与できることになります。
3つのRCTをまとめると以下のようになります。
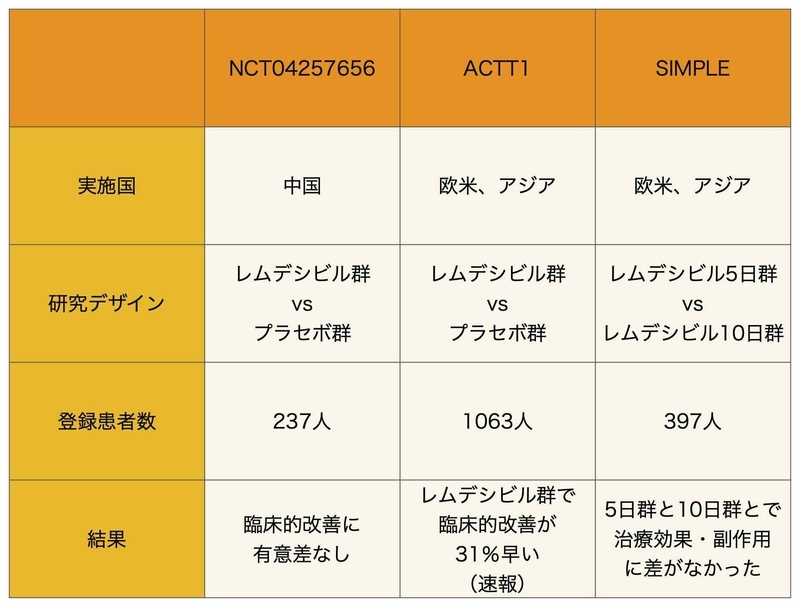
中国のRCTでは有効性は認められませんでしたが、NIHを中心とした多国間のACTTでは臨床的改善が短縮されました。
中国でのRCTは症例数が足りずに終了していたことから、予定通りの症例数が登録されていればACTTと同様に臨床的改善の効果が認められた可能性があります。
SIMPLEに関しては有効性の検証というよりも適切な治療期間の検証であり、5日間でも十分であることが示唆されています。
臨床的改善までの時間が短くなるとはいえ、新型コロナの患者さんにレムデシビル投与しても亡くなる患者さんはプラセボ群と同程度いるため、劇的に効く薬剤とは言えないようです。
国内で承認された場合に、どのような事例が投与対象となるのかが問題となります。
レムデシビルは点滴での使用となりますので、入院するようなある程度重症の患者さんへの使用が想定されます。
これら3つの臨床研究では、
・肺炎がある
・酸素飽和度(体内の酸素が足りているかどうかの指標)が94%以下
・酸素吸入を必要とする
・人工呼吸管理を必要とする
など、中等症〜重症が対象となっており、日本国内でも同様の重症度が対象になる可能性が高いでしょう。
また今回の3つのRCTでは死亡を減らすことが示されたわけではありませんので(もともと亡くなる人の多くない感染症では示すことが難しい)、今後も引き続き他の有効な薬剤が待たれますし、今後は軽症患者も治療対象となるような有効な経口治療薬も望まれます。










