分野横断のセレンディピティ:化学と医学が出会って生まれた「光免疫療法」とは。開発者の小林久隆氏に聞く
セレンディピティ(Serendipity)とは、幸運な偶然が重なって予想外の発見が生まれるようなことをいう。分野横断型の研究開発では、セレンディピティから画期的な発見や発明が誕生することも多い。今回は、がん治療の最終兵器とされる光免疫療法を開発した小林久隆氏に、小林氏が自らマニアという化学と医学の分野横断研究について話をうかがった。
光免疫療法とは
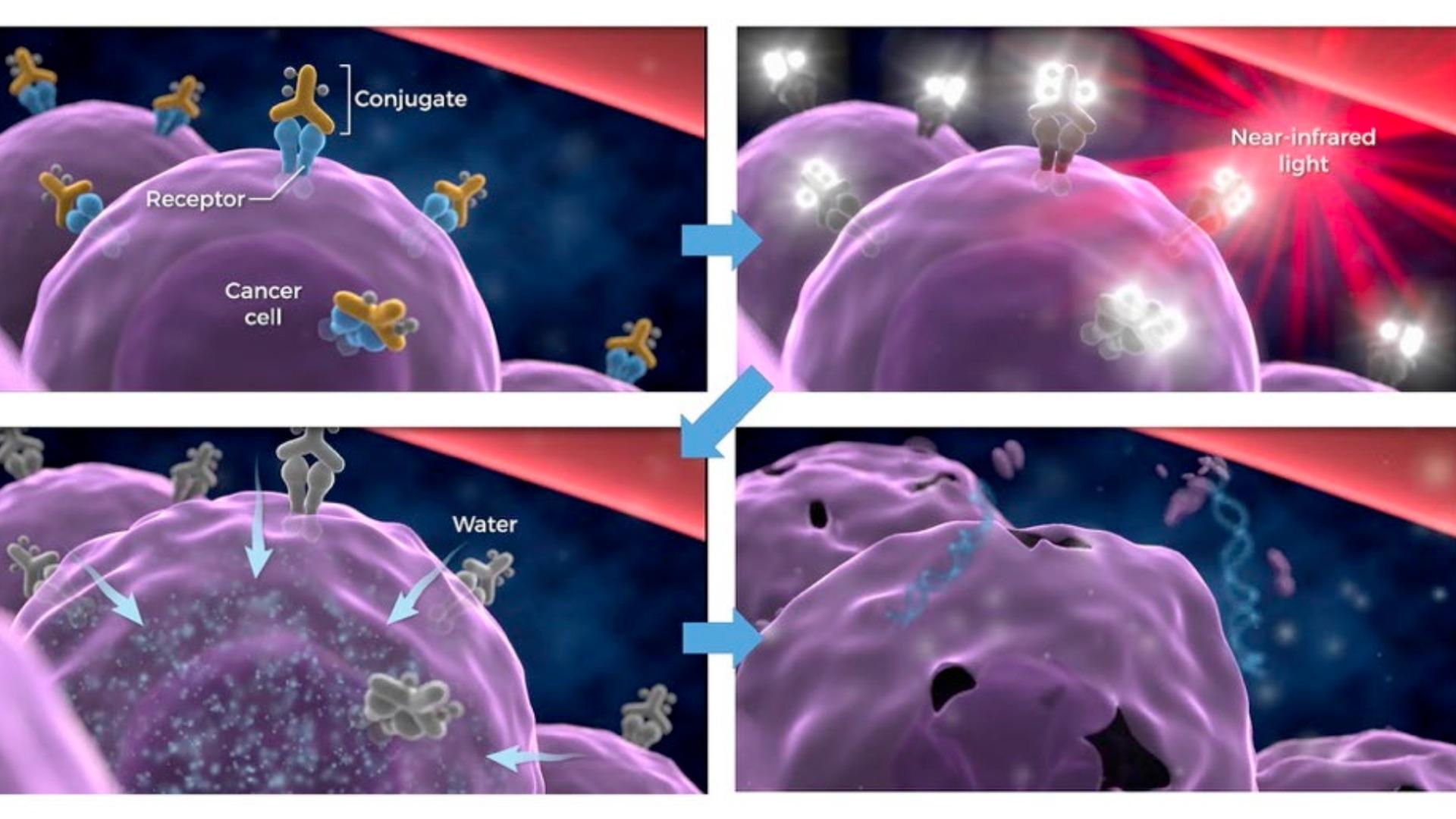
光免疫療法とは、米国の国立衛生研究所(NIH)の日本人研究者、小林久隆氏によって開発された新たながん治療法だ。2012年には当時のオバマ米元大統領の一般教書演説でも言及された光免疫療法は、健康な細胞をほとんど傷つけることなく、がん腫瘍細胞だけを選択的に破壊し、がん細胞だけを破壊することができる。
この光免疫療法は、近赤外線という光線と近赤外線光に反応するIR700という化学物質(光感受性物質)を用い、がん抗原と結合する抗体にIR700をくっつけて点滴で患者へ投与する。がん細胞の表面には、他の正常な細胞には少ない抗原(がん抗原タンパク質)があるので、がん細胞に抗体とIR700の結合体が結合する。
がん細胞へ直径1ミリメートルの光ファイバーによる近赤外線を数分間、照射すると、光に反応したIR700が結合している抗体の形を変え、それによってがん細胞の表面に物理的に穴を開ける。こうした現象が、抗体が結合したがん細胞の表面で無数に起き、がん細胞を次々に破壊していくというわけだ。
生かされた学生時代の化学の研究
この治療法を開発した小林氏は、自分について医学よりも化学に強い興味を持っていた化学マニアの医学生だったと言う。どんな学生時代だったのだろうか。
「小さい頃から理科が大好きでした。中学・高校時代は、まるで趣味のように化学の勉強に没頭していたんです。灘高校2年で高校の化学はすべてわかってしまって大学の化学の教科書を読み漁って勉強していました。京都大学医学部に入学した頃から、理学部の先生に頼み込んで化学の実験をさせてもらっていたんですが、その先生は、生体分子のDNA、RNA、タンパク質、脂質、糖鎖なんかにいろんな機能的な分子をくっつけ、複合体を作るコンジュゲーションが一つの専門でした。どういう条件でどういう化学反応を使えば機能分子を生体物質にくっつけることができるのか、ということを私に教えてくださったんです」
生体分子に機能的な別の分子をくっつける化学の実験や研究は、光免疫療法のキーテクノロジーと共通する部分があるという。
「もちろん、当時の私は単に化学に興味があったからやっていたわけですが、何かと何かがくっつくためには一度、エネルギーが上がって反応する状況になってくっついて、またエネルギーが元に戻るわけです。今、光免疫薬剤の合成や光を照射したときに細胞が破壊される原理など、この光免疫療法で使っている光に反応するIR700という物質を抗体にくっつける手法や光エネルギーによってIR700が変化する反応というのは、まさに当時の私がやっていたことの延長にあるものなんです」
小林氏はこのように一風変わった医学生だった。当時、熱中した化学の実験や研究が今の光免疫療法の開発に生かされている。
「ありがたいことに、当時から医学の世界で実際に使える化学を教えてもらえたというわけです。ですから、当時の同級生はみんな、私は医者にはならず、研究者になると思っていたでしょう。医学部の講義にもあんまり出てこないし、どこへ行ったかと思えば理学部で化学の実験をやってたりしてましたから」
小林氏は学部を終えた後、研修医として放射線科で臨床現場を経験する。実は放射線科も化学に近い分野だった。
「もちろん、医学生ですから医学の勉強もしなければなりません。私は医学部で勉強していた頃、なぜ病気になるのかを知る病理学に興味を持ち始め、病理学教室に通うようになりました。そこで抗体に出会ったんですが、当時の先生から病理をやりたいなら一度は臨床で経験を積んだほうがいいと言われ、研修医は放射線科を選びました」
京都大学附属病院の放射線科で研修医として働き始めた小林氏は、そこで化学と医学に結びつきがあることを知る。
「放射線科で研修してわかったことは、当時の画像診断はX線写真を読むだけではなくもうすでに造影剤を使ってCTやMRIで患部を診断する方法に変わっていたことです。また、放射線のついたいろいろな薬剤を作って、その集まりを観察して診断するようなこともやっていました。そのせいもあって私が興味を抱いていた化学との親和性が強い分野だなと思ったことを覚えています。医師はあまりそういうことを考えないのかもしれませんが、薬剤というのは全て化学物質なんです。私は化学マニアだから薬剤の化学成分や作用機序なんかを知ることが好きだったので、患者さんへ処方する薬剤があれば添付文書を必ず隅から隅まで読んでいました」
臨床研修の現場でも化学マニアの視点から様々な疑問を持ち続けた小林氏だが、光免疫療法へいたるヒントも当時、考えていたのだという。
「MRIはそうしたリスクはありませんが、CTやPETには放射線を使うと被ばくのリスクがあります。機械にはそれぞれ特徴があって見えるものが違うので、MRIがCTやPETに取って代わってもいいかといえばそうではありません。薬剤という意味では、PETに比べ、MRIでは猛烈にたくさんの量の薬剤が必要になってきます。放射性物質ではフェント(10の15乗分の1)モラーレベルのごく微量でも検出できますが、MRIの信号を得るためにはナノ(10の9乗分の1)モラー、マイクロ(10の6乗分の1)モラーのオーダーの濃度が必要で、CTではミリ(10の3乗分の1)モラーの単位にまで薬剤の量を何百億倍も増やさなければなりません。高い薬剤の濃度が必要なCTの場合には多い場合には末梢血管から毎秒5ccで200ccという、かなりの量を打つわけです。私も研修医の頃は、自分の担当の患者さんへそんな量をトライアルで打つことに納得できず、教授とぶつかったこともありました」
がんに効く治療法を確立したいという強い想い
「もちろん、MRIの薬剤にせよ、CTの造影剤にせよ、医療現場では安全を確認して使っているわけですが、例えばCTの造影剤は靴の上にたらしたら乾いて真っ白けになるほどのものです。化学分野の人間からすると、そんな水溶液といえないようなものを患者さんの身体に入れて本当に大丈夫なのか、という疑問もあったわけです。そのためにも化学として興味深く、ごく微量の化学物質でいいのか、どの程度の量を作って使わなければならないのか、興味深いものがありました。また、造影剤がたくさん集まって光るのは単に血流が多いだけなので、もうちょっと何かできないのかな、というのは当時からずっと考えていたことなんです」
研修医を追えた小林氏は、出身大学と同じ大学の大学院へ戻る。大学院では、やはり医学の中でも化学に関係の深い抗体の研究を始めた。
「大学病院の放射線科では、多くの患者さんが治療の甲斐なく亡くなるという現実に直面しました。なんとかして、がんを治す方法がないか、朝から晩まで臨床の現場で働きながら考え続けました。放射線科では4年間研修していたんですが、そうした想いから29歳の時に大学院へ入学し、がん治療のターゲットとして抗体の研究を始めたんです。抗体というのはタンパク質の分子なので、化学的な研究も、また薬剤としての研究もできます。ですから、大学院では本格的に細胞生物学と抗体創薬の基礎研究を始めました」
大学院を終えた小林氏は、がん研究のトップ機関である米国の国立衛生研究所(NIH)へ留学する。34歳の時だった。
「NIHで最初は放射性同位元素や抗がん剤を抗体に結合させ、がんをやっつける研究を始めましたが、放射性同位元素や抗がん剤はどちらも患者さんにとって毒になります。毒になると患者さんの体が耐えられる量に限度ができてしまうので、治りきるまで制限なく使ってがんをやっつけるためには抗体と結合させる物質は無害なものでなければならないと考えました。同時に、がんを光らせる研究もしていたので、イメージングのための物理的なエネルギーとして光と化学を使う方向へ向かうわけです」
光免疫療法にいたるヒントと化学との結びつきは、どこにあったのだろうか。研究を続ける中で、次第にアイディアが形になってきたと小林氏は言う。
「もちろん、米国へ留学した頃から具体的に今のような技術を考えていたわけではありません。ただ、できる限りがんだけ観察できる技術があれば、できる限りがんだけを殺せる可能性があるわけです。いかに特異的にがんを見せるのかがイメージングの目標でしたし、そこにたどり着けば先にはもっと治療に進化する可能性があるのではないかということは考えていました」
その後、NIHで研究を続けた小林氏は、43歳の時に自分の研究室を持ち、抗体に結びつける無害で近赤外線に反応する物質を探すことに没頭する。無数の組み合わせの試行錯誤を繰り返し、IR700という物質に巡り会うことができたのは2009年のことだった。
「がん細胞だけを光らせること自体は2008年にできていました。でも、がんにダメージを与えたり破壊したりすることができなかった。出入りの業者が持ち込んだ候補物質の一つがIR700でした。IR700が光免疫療法に使えるのではないかというヒントをくれたのは当時、日本から留学していた小川美香子(現・北海道大学教授)さんです。彼女はIR700に近赤外線を当てるとがん細胞が壊れて実験が失敗してしまうと報告してきたんですが、私は壊れるのならがん治療に使えるのではないかと考えたんです。私のこの発想は、学生時代に化学をやり、研修医時代に放射線医学や核医学をやってきたからできたことでしょう」
学会で認められるためのハードル
ただ、この現象を理論的に説明し、『Nature』などの学術誌や学会で認めてもらうことにも努力が必要だった。新しい治療法が臨床で使われるためには多くのハードルがあるようだ。
「がんの細胞膜で起きている現象は1秒間に数百ナノメートル以上動くレベルですが、その中で観察しなければならない現象は数ナノメートルレベルです。数ナノメートルの動きを観察することは凍結して固定しない限り技術的に不可能ですし、凍結してしまっては細胞に起こる現象も止まってしまうので、元も子もありません。ですので常温の生体内でがん細胞にくっついた1分子の動きを画像で視覚化して見せるのは不可能ですから、腫瘍細胞が破壊される現象を証明するためには、定量化しなければなりません。なので、細胞上で起こっている現象をいろいろな大きさのスケールで定量定性評価をして学会で見せたわけです」
だが、学会はそれでも納得しなかったという。最後に、生のタンパクの1分子イメージングでこの化学反応で起こる前後の形態変化を可視化して見せてやっと納得してもらえたと小林氏は言う。
「論文を出したのが2008年、メカニズムがわかったのは2013年です。光免疫療法の原理を学会に認めさせるのに5年かかったというわけです。どうしても難しい部分を大小両側から攻めて定量的評価をし、分子レベルから大きさを上げていって逆に細胞レベルから下げていくという両サイドから埋めていき、こうならざるを得ないことを証明する作業が必要でした」
今では広く認められ、日本で保険適用の治療も行われている光免疫療法。小林氏が多くの講演でこの治療法を説明する機会も増えた。だが、医学系、化学系、それぞれの専門家で反応が異なると言う。
「がん細胞を物理的に破壊するのも光免疫療法の特徴ですから、これは化学と物理と医学が融合した研究です。ある高名な先生から、化学者と物理学者と生物学者を3人、同じ部屋に入れておいてもできない。小林先生の頭の中でぜんぶやっているから可能だった研究なんですよ、と言われたことがあります。ただ、化学分野の先生方に話し始めると化学の部分では興味深そうに耳を傾けてくださるんですが、そこから生物学へ話が移ると途端に理解不能な感じになってしまいますし、医学から化学へというようなケースも同じ反応です。もちろん、それぞれの分野で深掘りする研究は重要です。一方で、おもしろいものを作り出すためには他分野とか広い視点で考えて、裾野から積み上げていって高みへいたるという過程も必要なのではないでしょうか」
化学マニアの少年が医学部へ入り医者の道を目指す過程で、がんの治療で多くの患者を救いたいと願った。到達したのは光免疫療法。それは化学と医学、物理学の幸福な出会いで生まれたがんの最終兵器だった。

小林久隆(こばやし・ひさたか)
1961年、兵庫県生まれ。京都大学医学部卒業、医学博士。米国国立衛生研究所(NIH)分子イメージングプログラム主任研究員。関西医科大学光免疫医学研究所所長。第38回日本核医学会学会賞受賞(2000年)、NIH長官賞受賞(2014年)、米国国立がん研究所(NCI)長官個人表彰(2017年)など。
分野横断のセレンディピティ連載企画










