カロリー制限で「長寿」になる理由がわかった

それぞれの生物が、生まれてから老衰で自然死するまでの最長記録を「限界寿命」と言う。あらゆる種類の生物に限界寿命があるが、サイズが小さく体重の軽い生物のほうが限界寿命は短い傾向があるようだ。
寿命は老化と関係する。老化が進めばやがて死ぬが、生物の寿命に限って言えば、長生きさせる方法が一つわかっている。それはダイエット。太り過ぎないことだ。
カロリー制限、食餌制限をすると多くの実験動物が長生きした。例えば、線虫しかり、ショウジョウバエしかり、マウスしかり、サル(※1〜※4)しかり。特に哺乳類で特徴的だが、ヒトでこれを実証した研究はまだない。倫理的にも難しいだろうからアカゲザルを使う(※5)。
DNAの「メチル化」がキー
ダイエットにより寿命が伸びることは、もう何十年も前からわかっていたが、そのメカニズムは長い間、謎だった。今回、その謎を解き明かす論文(※6)が英国の科学雑誌『nature Communications』に出た。
米国フィラデルフィア州のテンプル大学の前川真治(現・テキサス州立大学MDアンダーソンがんセンター)らは、加齢とともに変化するDNAの後天的な化学修飾の変化(ドリフト、Epigenetic drift)に着目し、カロリー制限による長寿の仕組みと化学修飾の関係を明らかにした。
前川は、DNAが化学修飾される領域は、マウス、アカゲザル、ヒトに共通で多くの領域が重複している、と言う。また、マウスとアカゲザルとでは、カロリー制限食で飼育することで、化学修飾の変化が軽減していることもわかったそうだ。
生物は発生や細胞を分化させる際に「メチル化」という一種のパイロット機能をDNAに付随させ、発生や分化を間違えないよう的確に導いている。化学的にDNAを「修飾」するメチル化は、後天的な遺伝子の変化「エピジェネティクス(epigenetics)」の一種でもある。
細胞内DNAのメチル化は増加や消失する。これまでの研究では、DNAのメチル化は加齢とともに変化し、細胞年齢のバイオマーカーとなることが示唆されてきた。つまり、一種の「遺伝子時計(epigenetic clock)」のような指標になるわけだ。また、がんやパーキンソン病などの神経変性疾患と関係があることも知られている。
エピジェネティクスな「遺伝子時計」とは
マウスのように寿命が短い種ではこの遺伝子時計の針の動きが速く、我々ヒトなどの寿命の長い種では動きが遅い。前川らは、生物の種の間で保存されているメチル化の変化率(ドリフト率)を、マウス、アカゲザル、ヒトと比較した。
アカゲザルでは7歳〜14歳の時期からカロリーを30%制限して22歳〜30歳まで育成した群とカロリー制限していない群を比べた。すると、DNAのメチル化が減少し、その遺伝子時計は7歳近く若い状態に保たれていることがわかった。また、マウスでは0.3歳からカロリー40%制限をスタートし、2.7歳〜3.2歳の群を作成。こちらのほうはアカゲザルよりも顕著に遺伝子時計の進み方が遅くなった、と言う。
つまり、カロリー制限すると細胞内DNAのメチル化の変化量が減り、そのことで細胞の寿命が長くなる、というわけだ。逆に考えれば、カロリー過多では細胞の寿命が短くなる可能性もある。
これまでサーチュイン(sirtuins)遺伝子といった「長寿遺伝子」が探索されてきた(※7)。また、ミトコンドリアの遺伝子が加齢と関係している、とする説も根強い(※8)。
今回の研究は、遺伝子そのものではなく、遺伝子に対する化学的な修飾が寿命と関係していた、とするところが興味深い。そのため、この遺伝子修飾は一代限りで終わりとなる可能性が高い。
──DNAのメチル化は次世代へ受け継がれるのか。
前川「カロリー制限を行う時期や程度、期間にもよるだろうが、次世代へ受け継がれる可能性は今のところ否定も肯定もできない。また、メチル化などの解析はされていないが、胎生期のカロリー制限(親マウスに対するカロリー制限)により、出生する仔マウスが過食症になる傾向が高くなるという報告もある」
──エピジェネティクスでは、ヒストン(DNAを折りたたんで格納するタンパク質)も化学修飾するが、今回の遺伝子時計と関係はあるか。
前川「ヒストン修飾に関して今回は解析していないが、これまでの解析により遺伝子時計が関係する領域は、遺伝子発現を抑制するヒストン修飾のタンパク質群の標的である場合が多いことが分かっている。また、ヒストン修飾も加齢に伴って変化する、という研究報告が複数ある」
──マウスとアカゲザルでカロリー制限に関するメチル化領域に違いはあるか。
前川「カロリー制限が特定の領域のメチル化状態に影響を及ぼすのではなく、(遺伝子時計の速度に依存し)すべての領域に影響を与える。また、どのような経路に関する遺伝子が老化によりメチル化を受けるのかを解析したところ、マウス、サル、ヒトとも、がんに関与する遺伝子が最も多く含まれていた」
臨床応用はまだ先か
──この遺伝子時計を計量化し、加齢やカロリー制限の指標に使えるか。
前川「本研究では臨床応用までの検討は行っていない。マウスやサルといった実験動物では、生活環境や餌、遺伝的背景も含め、比較的均一に保つことができるが、ヒトではバリエーションが大きすぎるため、臨床応用する場合はさらなる基礎研究が必要となってくるだろう。今後、同一個体から経時的にサンプリングした血液などを用いるなどしての解析が必要だ」
今回の論文では、カロリー制限と細胞寿命の関係が明らかにされた。前川は、カロリー制限がDNAメチル化に及ぼす影響は、異なる組織にわたって検出可能であり、遺伝子発現とも相関した、と言う。そして、こうしたエピジェネティックな変化(ドリフト)は哺乳動物の寿命の決定因子である、と主張している。
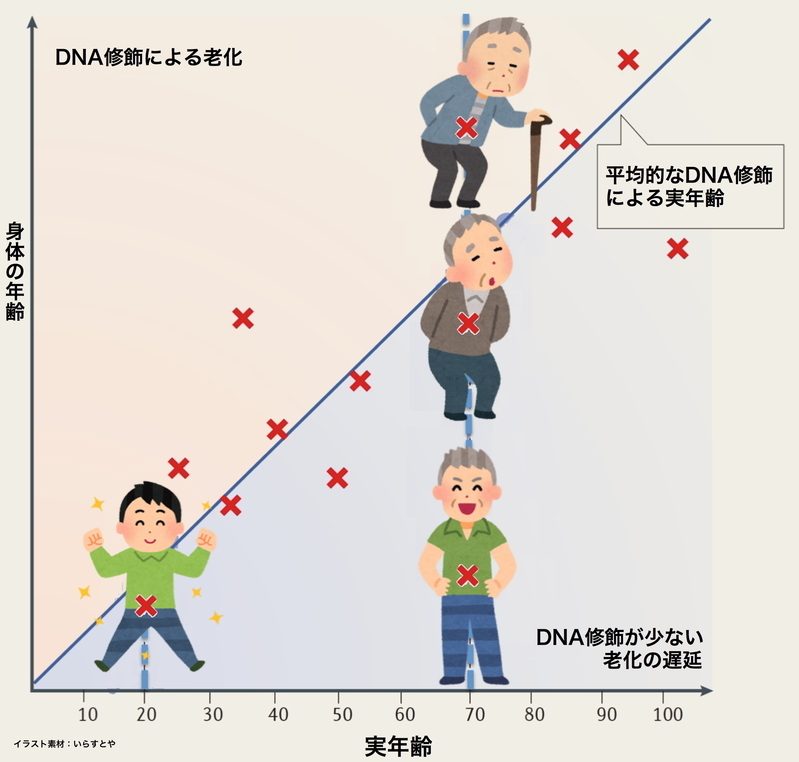
エピジェネティクスな遺伝子時計の図。縦軸は身体的な健康年齢、横軸は実年齢、DNAのメチル化イベントが「×」印になっている。この遺伝子時計の針が早く進めば実年齢よりも身体が老化し、遅く進めば実年齢より若々しくなる。例えば、肥満患者の場合、肝臓の細胞組織でDNAのメチル化年齢が加齢される。また、血液細胞のDNAもメチル化によって死亡リスクが高くなることが知られている。Via:Anne Brunet, et al., "Epigenetic regulation of ageing : linking environmental inputs to genomic stability." nature reviews, molecular cell biology, Vol.16, Oct, 2015 の図を元に改編した。
生物共通のエピジェネティクスな化学修飾(DNAのメチル化)を理解し、それを医薬的に臨床応用する試みが実験動物レベルで行われている。寿命を伸ばす薬物も線虫の研究ではすでに同定されており、近い将来、アルツハイマー病などの年齢関連疾患の治療に役立てられるようになるかもしれない。
また、メチル化による老化の影響を受ける遺伝子が、がんに関係する遺伝子に多い、ということで、がん治療にも使われる可能性がある。この分野の研究は、メタボリック症候群や加齢、神経変性疾患、がんなどの解明と治療に大きく役立てることのできる可能性を秘めているのだ。
※1:Nicholas A. Bishop & Leonard Guarente, "Two neurons mediate diet-restriction-induced longevity in C.elegans", Nature 447, 545-549 (31 May 2007)
Sakiko Honjoh, Takuya Yamamoto, Masaharu Uno & Eisuke Nishida, "Signalling through RHEB-1 mediates intermittent fasting-induced longevity in C.elegans", Nature 457, 726-730 (5 February 2009)
※2:Stephen L. Helfand, Blanka Rogina, Robert A. Reenan, and Steven P. Nilsen, "Gene Mutation Extends Lifespan in “I'm Not Dead Yet” Fruitflies", National Institute on Aging, December 2000.
※3:Lin Yan, Dorothy E. Vatner, J. Patrick O'Connor, Andreas Ivessa, Hui Ge, Wei Chen, Shinichi Hirotani, Yoshihiro Ishikawa, Junichi Sadoshima and Stephen F. Vatner, "Type 5 Adenylyl Cyclase Disruption Increases Longevity and Protects Against Stress", Cell, Volume 130, Issue 2, 247-258, 27 July 2007
※4:Ricki J. Colman, Rozalyn M. Anderson, Sterling C. Johnson, Erik K. Kastman, Kristopher J. Kosmatka, T. Mark Beasley, David B. Allison, Christina Cruzen, Heather A. Simmons, Joseph W. Kemnitz and Richard Weindruch, "Caloric Restriction Delays Disease Onset and Mortality in Rhesus Monkeys", Science 10 July 2009: Vol. 325 no. 5937 pp. 201-204
※5:R J. Colman, R M. Anderson, S C. Johnson, E K. Kastman, K J. Kosmatka, T M. Beasley, et al., "Caloric restriction delays
disease onset and mortality in rhesus monkeys." Science, 325, 201-204, 2009
※5:前川真治氏によると「サルを用いてカロリー制限の研究をしている機関は世界で2箇所のみだ。ウィスコンシン大学・ウィスコンシン国立霊長類研究センターと米国国立老化研究所。ウィスコンシン大学は今回の共同研究先となる」とのことだ。
※6:Shinji Maegawa, Yue Lu, Tomomitsu Tahara, Justin T. Lee, Jozef Madzo, Shoudan Liang, Jaroslav Jelinek, "Ricki J. Colman4 & Jean-Pierre J. Issa1Caloric restriction delays age-related methylation drift." nature communications, DOI: 10.1038/s41467-017-00607-3, 2017
※7:Howitz KT, Bitterman KJ, Cohen HY, Lamming DW, Lavu S, Wood JG, Zipkin RE, Chung P, Kisielewski A, Zhang LL, Scherer B, Sinclair DA., "Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan.", Nature. 2003 Nov 13;426(6963):119. Nature, ;425(6954):132-3, 2003
※8:Marta Artal-Sanz & Nektarios Tavernarakis, "Prohibitin couples diapause signalling to mitochondrial metabolism during ageing in C.elegans", Nature 461, 793-797, 8, October, 2009










