「がん診断」の新技術「短波赤外蛍光イメージング」とは。北海道大学などの研究

がん診断における分子イメージング技術の一つ、短波近赤外蛍光イメージングでは蛍光物質の開発が必須だが、北海道大学などの研究グループがヒトでの応用が可能な蛍光色素の開発に成功した。他の分子イメージングとどう違い、どんな利点があるのだろうか。
短波赤外による光イメージングとは
21世紀に入ったあたりから、物質内の情報を画像として読み取る技術が急速に発達した。特に医療分野では、生体内の様子を分子レベルでイメージングし、がんの病態などを評価する診断法が臨床現場で広く使われるようになってきており、患者の身体への負担の少ない方法(非侵襲性)となっている。
がん診断における分子イメージングには、核医学(PET-CTなど)、MRI(磁気共鳴画像)、光イメージングなどがあるが、放射線被ばくなどの患者への負担の大小、感度・深度(空間・時間分解能)の性能など、それぞれメリットデメリットがある。この中で、患者への負担が少なく感度が高いのが近赤外蛍光イメージングだ。
蛍光とは、ある光があたった場合、あたった光のエネルギーよりも小さな光(短波長→長波長)を放出する反射光のことだが、多くの蛍光物質は特定の範囲の波長の光を吸収して放出する特性を持つ。
この蛍光物質の性質を利用するのが蛍光イメージングで、ICG(インドシアニングリーン、シアニン色素)などの蛍光色素や5-ALA(ファイブ-アラ)といった光感受性タンパク質を蛍光物質として使い、蛍光ラベル化(抗体やタンパク質を蛍光物質で強く発光させる)により、がんだけを特異的に光らせることもできる。
近赤外でも波長の短いものを短波赤外(Shortwave-Infrared、SWIR、波長900ナノメートルから2400ナノメートル)という。生体のせいぜい1ミリメートル程度の深部しか観察できなかった蛍光による光イメージングだが、短波近赤外の波長を使う光イメージングでは10ミリメートル以上を可視化できるようになっている。
近年、これまで身体の深部まで届かなかった光イメージングの欠点をおぎなう診断法、蛍光誘導手術法、薬剤開発手段として、光毒性(光が照射されることで起きる生体への悪影響やアレルギー反応など)の低い900ナノメートルから1400ナノメートルの短波赤外による光イメージングとそれに利用できる蛍光物質(造影剤、プローブ)の研究が進められている(※1)。
新たな蛍光色素を開発
X線を利用した乳がん診断のマンモグラフィーでは放射線被ばくの恐れがあるが、それに代わる早期の乳がんを高感度に診断できる低侵襲性の方法として、短波赤外による光イメージング技術とヒトに対して安全な蛍光色素が求められてきた。
短波赤外で発光する蛍光色素の有力候補が前述したICG(シアニン色素)で、米国FDA(食品医薬品局)の承認を受けている短波赤外に用いることのできる唯一の蛍光色素だ。
しかし、ICGの発光する波長は900ナノメートル以下であり、900ナノメートルから1400ナノメートルの短波赤外の光イメージングには使えなかった。
短波赤外で発光する蛍光物質(色素)の開発が求められているが、北海道大学などの研究グループ(※2)が、ICGの炭素の二重結合(ポリメチン鎖、※3)を延長し、922ナノメートルで発光する色素(ICG-C9)と1010ナノメートルで発光する色素(ICG-C11)の二つの色素を合成することに成功し、米国化学会の学術誌で発表した(※4)。
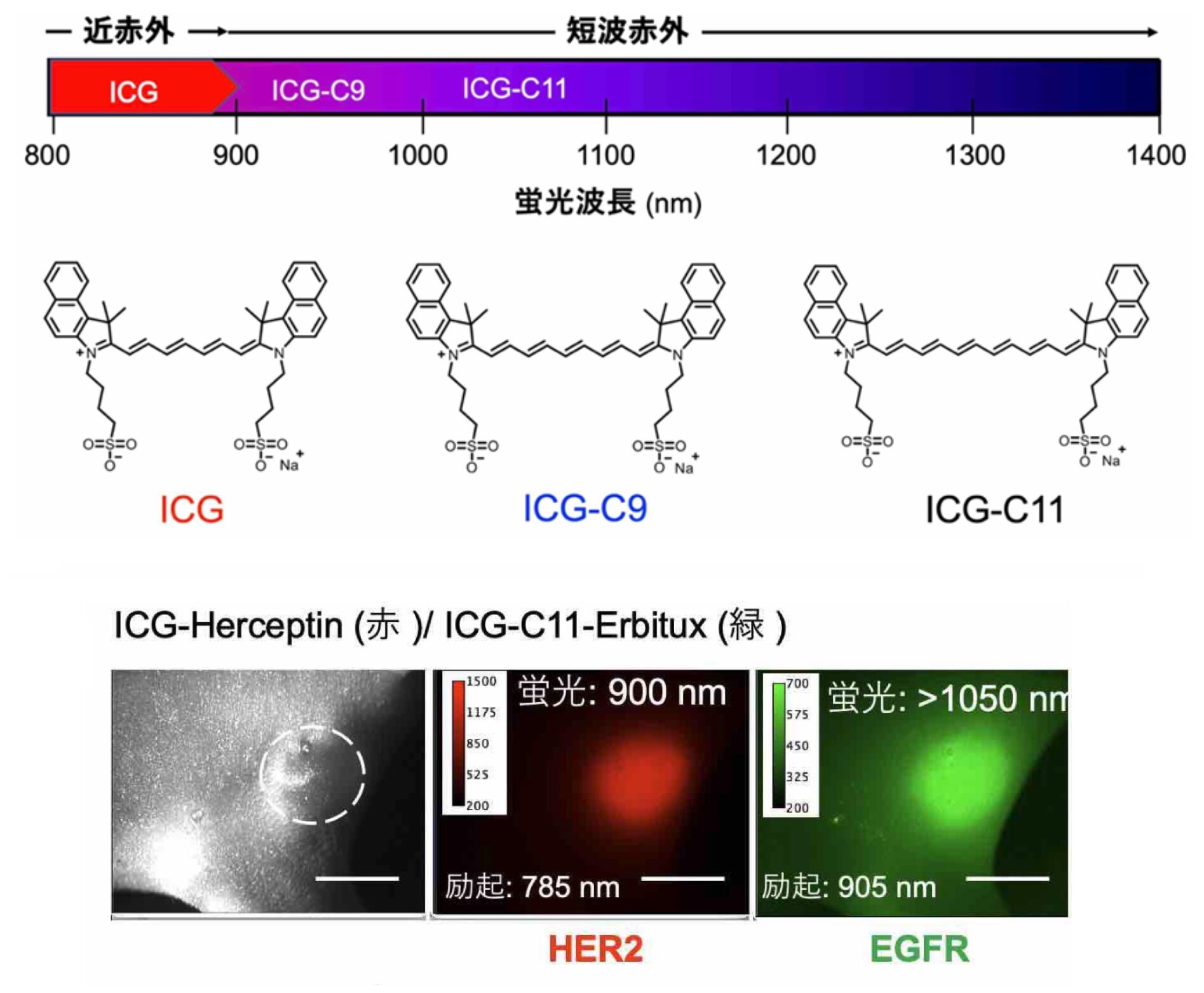
すでに同研究グループは、2021年に電子共有結合(π共役、π軌道結合、単結合と多重結合の共有結合)により、生体親和性の高いICG色素を合成し(ICG-C11)、それを使った短波赤外での光イメージング(10ミリメートル)に成功している(※5)。
今回は、新たにICG-C9を加えたことで、従来のICG、ICG-C11を使えるようになり、蛍光ラベル化によって、がん診断の光イメージングの範囲を広げることができるようになった。
同研究グループによる新たな蛍光物質を使った短波赤外蛍光イメージングでは、蛍光ラベル化によって乳がん腫瘍(がん細胞表面の受容体)を可視化し、長期間(38日間)の観察を可能とし、抗がん剤治療の効果が確認することができる。安全性の高い効果的な光イメージング診断といえ、臨床現場での実用化が期待できそうだ。
※1:Mingkang Wang, et al., "Symmetry-breaking charge-transfer enables turn-on fluorescence sensing in the shortwave infrared spectral region for in vivo vasculature redox homeostasis" Sensors and Actuators B: Chemical, Vol.394, 134382, 1, November, 2023
※2:北海道大学大学院先端生命科学研究院(門出健次教授、マハデバ・スワミイ助教ら)、北海道大学大学院農学研究院(村井勇太准教授ら)、理化学研究所生命機能科学研究センター無細胞タンパク質合成研究チーム(神隆上級研究員、研究当時はナノバイオプローブ研究チームチームリーダー、坪井節子テクニカルスタッフ、研究当時はナノバイオプローブ研究チームテクニカルスタッフ)らの共同研究チーム
※3:炭素─炭素の結合が二重結合を介して繋がった炭素鎖(─CH2=CH2─CH2= CH2─CH2=CH2─)の鎖
※4:Mahadeva M. Swamy, et al., "Biocompatible and Water-Soluble Shortwave-Infrared (SWIR)-Emitting Cyanine-Based Fluorescent Probes for In Vivo Multiplexed Molecular Imaging" ACS Applied Materials & Interfaces, Vol.16, Issue14, 17253-17266, 1, April, 2024
※5:Mahadeva M. Swamy, et al., "Shortwave-Infrared Fluorescent Molecular Imaging Probes Based on π-Conjugation Extended Indocyanine Green" Bioconjugate Chemistry, Vol.32, Issue8, 1541-1547, 26, July, 2021