治療の難しい「がん」に新たな免疫療法を開発、北大など
我々の免疫系には、がん細胞を発見して攻撃する機能が備わっている。だが、がん細胞もこの免疫機能を逃れようとする。今回、北海道大学などの研究グループが、免疫機能から逃れようとするがん細胞を攻撃する新たな免疫療法の技術開発に成功した。
がん細胞が免疫系の攻撃を逃れる戦略とは
病原体などの異物が体内へ侵入した際、我々の身体は、それを発見して攻撃、排除する免疫系の機能を持っている。がん細胞も異物(異常細胞)であり、がん細胞が発生したら初期のうちに免疫系の機能がそれを発見して攻撃、排除する。
リンパ球の一種で免疫系の司令塔となるT細胞の中でも、CD8+T細胞というキラー細胞(細胞傷害性T細胞)は、がん細胞を発見して攻撃、死滅させる役割を持つ。がん細胞を発見するメカニズムは、がん細胞の表面に発現するT細胞受容体により、がん抗原を特異的に認識することで機能する。
このCD8+T細胞は、がん細胞を溶かしたり(パーフォリン)、グランザイムという酵素により、がん細胞の自死(アポトーシス)を誘導するなどしてがん細胞を殺傷する。
がん細胞のほうもまた、CD8+T細胞からの発見や攻撃を回避し、生き残り、細胞を複製し、増殖させるための戦略(免疫チェックポイント)を獲得していく。がん細胞の免疫回避戦略の一つが、MHC(Major Histocompatibility Complex)クラスI遺伝子という抗原の発現レベルを低下させることだ。
MHCクラスI遺伝子の発現が低下することは、がん細胞が免疫系からの攻撃を回避する一般的な方法とされているが、がん細胞は自分の細胞表面にあるMHCを消し去って、CD8+T細胞の発見や攻撃から逃れる。がんの免疫療法には、がん細胞が免疫系から逃れる免疫チェックポイントを阻害させて作用するもの(抗免疫チェックポイント阻害療法、PD-1療法など)があるが、MHCクラスI遺伝子の発現障害が治療の有効性を低める原因の一つと考えられている。
つまり、がん細胞を発見・攻撃する免疫系のメカニズムは、がん細胞の抗原としてMHCクラスI遺伝子の発現がなければ機能しないというわけだ。
がん細胞の特定の遺伝子をターゲットに
今回、北海道大学大学院医学研究院の小林弘一教授らの日米共同研究グループは、がん細胞の表面でMHCクラスI遺伝子の発現がなぜ低くなるのかを考え、がん細胞のNLRC5遺伝子という制御因子(プロモーター)の発現がメチル化という遺伝子修飾を異常な形で受けることで、MHCクラスI遺伝子の発現低下を引き起こしていることに着目した(※1)。
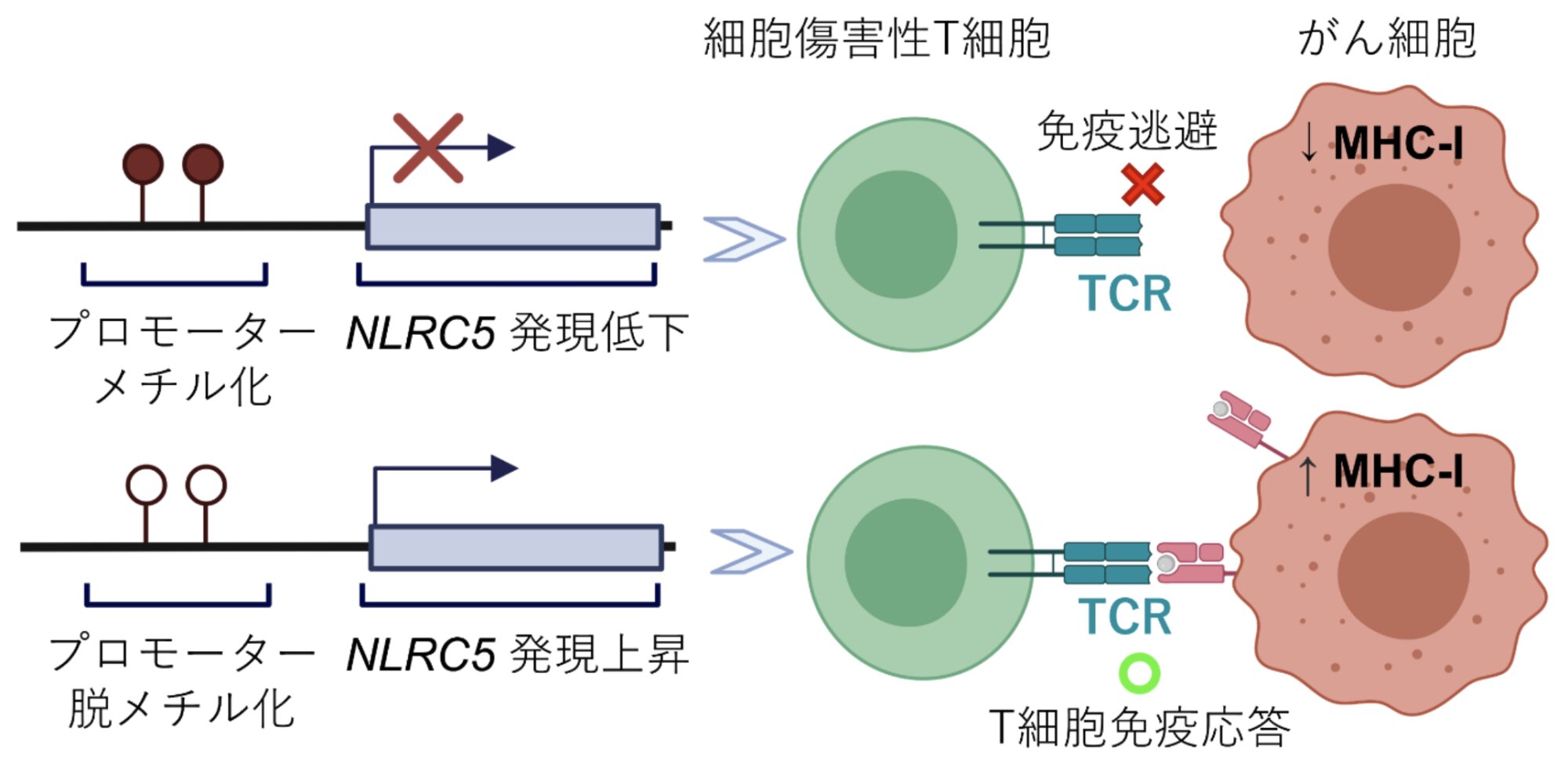
実際、がん患者ではNLRC5遺伝子の発現が多ければ、MHCクラスI遺伝子の発現も増加し、がん患者の良好な予後にも影響があり、がん抗免疫チェックポイント阻害療法(PD-1療法)の効果も高いことがわかっている(※2)。
そのため、同研究グループは、NLRC5遺伝子だけをターゲットにし、異常なメチル化修飾を正常化(脱メチル化)してNLRC5遺伝子を活性化し、MHCクラスI遺伝子の発現上昇を誘導する技術、TRED-I(Targeted reactivation and demethylation for MHC-I)というシステムを開発し、この成果を2024年2月1日に米国科学アカデミー紀要(PNAS)で発表した(※3)。
同研究グループは、このTRED-Iシステムについて、マウスの悪性黒色腫(メラノーマ)細胞やヒト乳がん細胞などで実験をし、NLRC5遺伝子の脱メチル化による発現の増加、それによるCD8+T細胞の抗がん免疫機能(細胞傷害性T細胞の応答、攻撃能力)の強化、がん抗免疫チェックポイント阻害療法(PD-1療法)の効果への好影響などを調べ、実証した。

また、がん放射線療法などの局所療法では転移した別の部位への抗腫瘍免疫応答も高くなることから、TRED-Iシステムも離れた部位に転移したがんに対して強力な抗腫瘍免疫応答を持つことを示している。
がん細胞のDNAを脱メチル化させる薬剤などはこれまでもあるが、重い副作用を生じさせることで問題も多いという。同研究グループは、TRED-IシステムがMHCクラスI遺伝子の発現に対して特異的に機能することから副作用も低く、将来的にはPD-1療法以外の抗免疫チェックポイント阻害療法に応用(併用)できる可能性があるとしている。また、TRED-Iシステムでは、単独でもCD8+T細胞が腫瘍の中心を効率的に攻撃することが観察されたという。
同研究グループは、今後の課題としてTRED-Iシステムを、がん細胞へ効率的に直接、送り込む技術を確立させたいとしている。
※1:Sayuri Yoshihama, et al., "NLRC5/MHC class I transactivator is a target for immune evasion in cancer" PNAS, Vol.113(21), 5999-6004, 11, April, 2016
※2:Sayuri Yoshihama, et al., "NLRC5/CITA expression correlates with efficient response to checkpoint blockade immunotherapy" scientific reports, 11, Article number: 3258, 5, February, 2021
※3:Xin Sun, et al., "Targeted demithylation and activation of NLRC5 augment cancer immunogenicity through MHC class I" PNAS, Vol.121(6), e2310821121, 1, February, 2024