ドラッグロス解消へ新薬スピード承認…がんや難病などで新制度導入の方針
厚生労働省は、がんや難病などの患者に薬を迅速に届けるため、効果が予測できる段階で製造販売を承認する新制度を導入する方針を決めた。承認後に効果が確認できない場合は取り消しを可能とする。欧米で承認された薬が日本で使えない「ドラッグロス」の解消策で、来年の通常国会に医薬品医療機器法の改正案の提出を目指す。 【図解】ひと目で分かる…創薬力強化を目指す政府の工程表のポイント
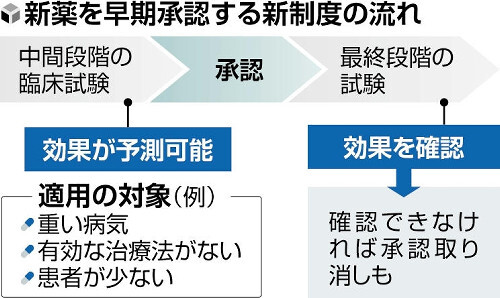
製薬企業が承認を得るためには通常、3段階の臨床試験(治験)を実施し、薬の安全性や効果を確認する。その上で、国に承認申請を行う。
新制度は、命に関わる重い病気や、有効な治療がない、患者が少なく臨床試験に時間がかかるなどのケースが対象となる。中間段階までのデータで効果を予測でき、患者が使う利点が大きいと判断された場合に承認する。安全対策のため、必要に応じて薬を処方できる医療機関や医師の条件を定める。
承認後は原則、最終段階の試験の実施を製薬企業に求める。効果が確認できなかった場合は承認を取り消せる仕組みとする。
米国には、新制度と同様の承認取り消しが可能な迅速承認の仕組みが導入されている。
厚労省は2017年、重い病気の新薬などについて、中間段階までのデータで効果が確認できれば、最終段階の試験を経ずに早期に承認する制度を設けた。
だが、製薬企業にとって条件のハードルはなお高い。これまでの適用は、がんや難病の治療で使われる5品目に限られており、厚労省は、新たな制度の導入が必要と判断した。
ドラッグロスは深刻化している。厚労省によると、欧米で承認済みだが、日本で未開発の薬が23年3月時点で86品目に上る。政府は今年7月に策定した創薬力強化に向けた工程表で、86品目のうち必要性の高い薬について、臨床試験を26年度までに始めるとする目標を盛り込んだ。
新制度が実現すれば、ドラッグロスが生じている薬の開発が日本で進みやすくなるほか、新たなドラッグロスの発生を防ぐ効果も期待される。