小林製薬“紅麹問題” そもそも機能性表示食品とは…国のお墨付きはない?【#みんなのギモン】
■トクホとの違い…国がお墨付きを与えるものではない?
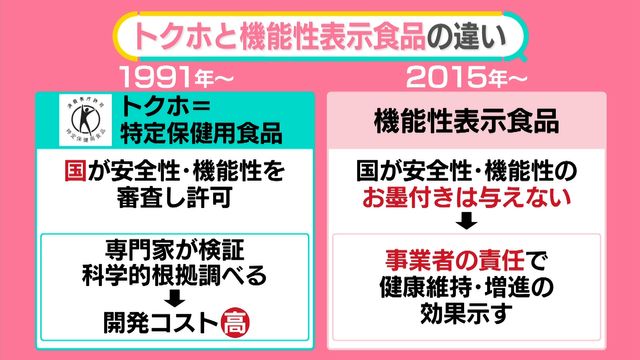
トクホは1991年から始まりました。国が安全性や機能性を審査して許可を出します。つまり、メーカーが出してきたものを専門家が検証するのです。科学的根拠を調べる分、開発コストが高くなります。 一方の機能性表示食品は、2015年になって導入されました。こちらは、国が安全性や機能性のお墨付きは与えません。事業者の責任で健康維持・増進の効果を示し、安全管理もメーカーが責任を負うことになります。 例えば、メーカーA社が、「睡眠の質を高める機能がある」とうたった機能性表示食品のサプリを製造したとします。売りに出すにあたりA社はどうするか。 まず、メーカー自身で安全性や機能性評価を行います。“この成分はこの論文によると、こんな機能がある”といったことを確かめます。さらに生産体制、品質管理の体制を決めるわけです。 こうしたことを書類にして、商品の販売60日前までに消費者庁長官に届け出ます。 消費者庁は届け出の内容について、つじつまはあっているか、しっかり論文などにあたって機能性や安全性を調べているかをチェックします。そして、問題なければ受理します。そのため、安全性や機能性を消費者庁が検証してお墨付きを与えるものではないのです。 国は確認をするレベルですので、責任はメーカーが負っているわけです。 過去には偽りもありました。医薬品メーカーなどが販売したサプリメントなどの機能性表示食品について「飲むだけで簡単にやせる」かのように宣伝していましたが、科学的な根拠はなかったということです。消費者庁が景品表示法に基づく措置命令を出しました。 私たちはどうすれば良いのか、食の問題に詳しい食品問題評論家の垣田達哉氏に話を聞きました。
垣田達哉氏 「機能性表示食品は薬ではなく、あくまで一般の食品の1つ。だから本来、機能性表示食品だからという理由で特に安全性に注意が必要というわけではない」 「ただ、機能性表示食品のサプリについては気にした方がいいこともある。1日2粒など、毎日飲むよう説明が書かれていることもあり、毎日飲むことが効くと思って飲むことが多い」 「そのため一定期間摂取したら一定期間やめてみて、体調がどうなるか様子を見てみるのがいいだろう。やめた方が調子がよくなった場合は、やめる選択肢もある」