わずかな兆候を発見、ごく微量な血液に3分間のレーザー照射で多種多様な「病気の超早期診断」が
病気の兆候を早期に発見できれば、早期に治療を始められ、回復に大きく寄与する。早期発見の技術にはいろいろあるが、日本の研究グループが赤外線レーザーをタンパク質へ照射することによる超早期診断の可能性に道筋をつけた。
リキッドバイオプシーとは
医療用語にバイオプシー(biopsy)という言葉があるが、これは生検(生体組織採取検査)のことだ。また、血液や便、尿、唾液、汗などの液状のサンプルを検査することをリキッドバイオプシーといい、リキッドバイオプシーは、身体への負担が少なく、ゲノム情報の分析や抗原・抗体を含むタンパク質の検出などにより、がん、心血管疾患、認知症、感染症などをリアルタイムかつ早期に検査できる手法となっている。
だが、リキッドバイオプシーによってゲノムやタンパク質を調べるといっても、PCR法は単にDNAやRNAをコピーして増やすだけで、タンパク質の分子自体の数を増やすことはできない。そのため、被験者や患者のタンパク質を、どうやったら効果的・効率的に検出できるのかが課題になってきた。
レーザー光で抗原抗体反応を加速
今回、大阪公立大学LAC-SYS研究所の飯田琢也所長、床波志保副所長らの研究チームが、赤外線レーザーを照射することでタンパク質の抗原抗体反応を高効率に検出できる原理と技術を開発し、学術誌に発表した(※)。同大学のプレスリリースによれば、この技術を使って一滴の血液からリキッドバイオプシーを行い、がん、認知症、感染症などの病気に関する物質の検出を超早期にできるようになるという。
同研究グループは「人間の血管程度の流路の中に抗体修飾ビーズと測定対象のタンパク質を導入してレーザーによる光圧で濃縮すると相互作用確率を高めて抗原抗体反応を加速できるはず」という基本的なアイデアから出発し、レーザー光という物理的な力を使い、物理学、化学、生物学の分野横断型の研究を行ってきたという。
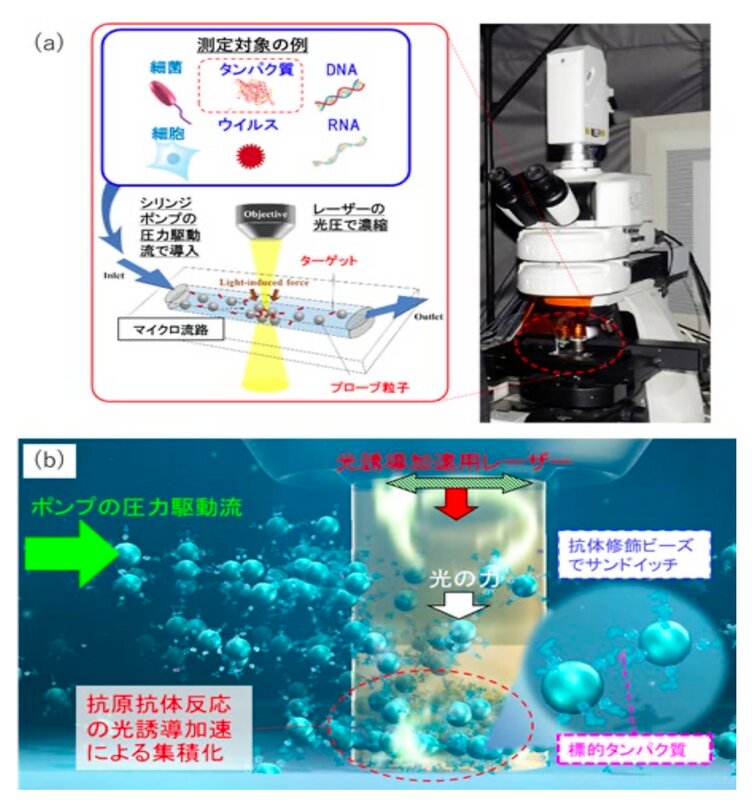
フォーカスを当てたのは、我々の身体の防御機構である免疫に関する抗原抗体反応だ。この反応をレーザー光によって制御し、高感度かつ迅速に計測することで超早期診断につながるという。
抗原抗体反応では、抗原のタンパク質にエピトープという抗原決定基(抗体が認識する抗原の構造単位)とパラトープという抗体決定基が結合する。例えば、獲得免疫細胞の一種であるB細胞は、進入してきた異物である抗原から抗体を作り出し、免疫機能として働かせる。
この抗原であるターゲット分子と抗体であるホスト分子のような組み合わせが、他の分子とは結合できないような特異的な認識の仕組みを分子認識機構という。この組み合わせる力を強制的に加速し、その反応を観察することができれば、高感度に素早く抗原抗体反応を検出することができる。
同研究グループは、幅100マイクロメートル(ヒトの微細血管や毛髪と同程度)の狭い流路に抗原抗体反応を起こす分子を流し、上面からスポット径70マイクロメートルほどの赤外線レーザーを照射することでレーザー光の圧力により、抗原抗体反応の確率(分子の衝突確率)を高めるという技術を確立した。その後、流路を流すことで結合した分子以外が除かれ、残った抗原抗体反応を捕捉することができる。
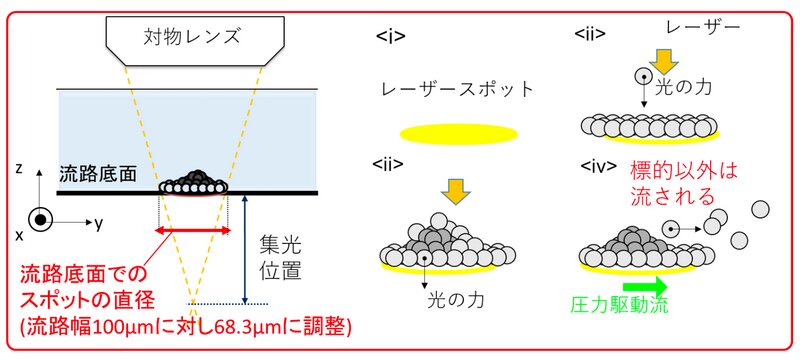
この技術を使い、3分間ほどのレーザー照射により、300ナノリットル(1センチ角のサイコロの体積の約333分の1)のサンプル中から47アトグラム(1アトグラムは10のマイナス18乗グラム、10アトグラムはウイルス1個と同じくらいの重さ)から750アトグラムの標的タンパク質の検出に成功したという。数時間が必要だった従来のタンパク質検出法と比べ、サンプル量で約300分の1、感度で約100倍を超短時間で実現したことになる。
医療分野だけでない広い応用へ
また、特殊な技法により赤外線レーザーによる熱的なダメージを検査生体組織に与えず、適度な流路の流速(毎秒100マイクロメートルから200マイクロメートル)により効率よく抗原抗体反応を促進することができたという。特に、レーザースポット径(約70マイクロメートル)と流路幅(100マイクロメートル)の組み合わせに苦労したそうだ。
同研究グループによれば、今後数年以内で基本的なシステムを開発し、臨床での検証につなげていきたいという。また、この技術は医療分野だけではなく、飲食物中のアレルギー物質の検査、環境中の生物由来の物質の検出、製薬プロセスでの中間生成物の検査などにも応用できると期待している。
※:Takuya Iida, et al., "Attogram-level Light-induced Antigen-antibody Binding Confined in Microflow" Communications Biology, 5, Article number: 1053, 6, October, 2022